【文章来源:博药(ID:PortonMKT)微信公众号。扫描或者识别下方二维码,即可关注博药,阅读更多行业深度与技术原创稿件,以及观看免费直播讲座~】

随着医药政策改革持续深化,为节约生产运行成本,更经济、快速生产多种剂型、多种规格产品的“药品共线生产”成了一个新的话题。那么什么是共线生产?共线有何注意事项?共线评估需要评估什么?
7月20日,博腾股份清洁SME赵成刚,对《药品共线生产质量管理指南》(以下简称“指南”)进行直播解读,对药品共线生产做了很好的诠释,下面一起温故知新,再享精华。
《指南》形成之路
谈到药品共线生产质量管理指南不得不提的是MAH制度(MarketingAuthorizationHolder,MAH)。
2015年11月国务院在全国十省市试点MAH制度,2016年6月,《药品上市许可持有人制度试点方案》出台,对试点内容,试点药品范围,各主体条件、义务及责任等方面进行了说明。
2017年10月23日,国家食品药品监督管理总局(下称CFDA)发布《关于推进药品上市持有人试点工作有关事项的通知》。
2018年10月,十三届全国人大常委会第六次会议决定,将MAH制度试点工作的3年期限延长1年。
终于在2019年12月01日,新版《药品管理法》开始实施,MAH制度正式上线,任何药品生产、运输、销售、使用过程的质量问题,可能都可以追究至药品上市许可持有人。
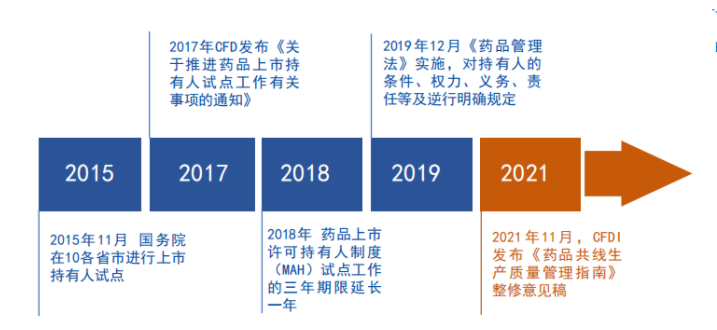
图片来源:博药直播讲者PPT
MAH制度的产生、一致性评价过评品种带量采购等政策的出台为CMO行业带来新的生机,同时有可能解决医药产业发展极度不平衡、产能过剩等问题。
以CDMO业务来讲,其服务范围贯穿药品生产研发全流程,协助医药企业从研发、临床前、临床阶段甚至是生产后的上市商业化阶段,通过这些服务为客户降低研发成本、提高生产效率、缩短药物研发周期、实现药物快速上市。所以MAH制度为CMOCDMO行业带来了巨大的机遇,同时也面临着更大的挑战。
为此,2021年11月12日,为指导和规范药品共线生产,NMPA核查中心组织研究起草并发布了《药品共线生产质量管理指南(征求意见稿)》。如何通过对方法的应用,来对药品共线生产中存在的风险进行管理,就显得尤为重要。进而需要了解的是共线生产存在哪些问题?
共线生产问题几何?
目前,共线生产存在问题主要有以下几方面:
一、对风险认知不足
对风险管理没有认识,过分流于形式
现场管理松懈,存在违反GMP的缺陷较多
二、缺乏专业的设计
设施、厂房布局不科学,设备原理不支持共线
气流分布污染风险严重
三、过度依赖验证
用验证结论替代必要的质量管理和质量控制措施,但验证的科学性和合理性存疑。
于是,2021年11月12日,为指导和规范药品共线生产,NMPA核查中心组织研究起草并发布了《药品共线生产质量管理指南(征求意见稿)》。它主要从以下两方面展开:
1.希望能够为国内企业的共线生产的管理和风险评估提供一个的工具
避免企业共线生产评估的空洞化和无有效的控制措施
能够给企业一个相对系统的评估策略、方法、标准
2.希望能够使用科学数据来进行分析、评估和判断共线生产的科学性,减少使用主观判断
建议使用基于健康的暴露限度(HealthBasedExposureLimits,HBEL)的方法来判断共线生产的风险严重程度
建议在设计共线生产策略时考虑药品生命周期原则
提出建议在清洁验证时考虑清洁方法生命周期原则
《指南》如何做指导?
博腾股份清洁SME赵成刚在对《药品共线生产质量管理指南》进行直播解读时,给出了答案。
首先他就《指南》结构框架进行梳理(见下图),然后就各章节逐一进行解读。

图片来源:博药直播讲者PPT
赵成刚指出《指南》分为七个章节。
第一章为总则,对于该指南制定的目的、定义、范围进行了解释。该指南适用于持有人和药品生产企业使用药品商业化生产线进行共线生产的产品或药品,包括非商业化生产规模的试制样品、临床试验药品、工艺验证所引入的模拟物料等。用于临床试验样品生产的非商业化生产线进行共线生产也可参考本指南的要求。
第二章中主要提出5条基本原则,即:遵守法律法规及规范要求、药品上市许可持有人主导原则、生命周期原则、质量风险管理原则、风险控制措施与收益整体平衡原则。遵守法律法规及规范要求明确定义范围,哪些情况下不允许共线,包括以下几种分类情况:
①基于法规要求:法律法规规章、国家标准明确使用专用设施或设备的(例如:高致敏药品、性激素类避孕药等);
②基于毒理学评价:毒理学评价得出的科学数据不支持交叉污染风险可控的;毒理学评价得到的相关检测限度不能通过已验证的分析方法检出的;
③基于交叉污染风险评估:污染和交叉污染风险不能通过操作过程和/或技术措施得到充分控制的。
第三章药品研发阶段对共线生产策略的考量,此阶段非常关键,但对于个别企业来说依旧薄弱。
目前而言,企业对于产品技术转移更为熟悉,但在药品研发阶段忽视共线生产策略,因此造成对于研发样品基本特性数据缺乏。于是在本章中明确药品研发阶段应充分考察研发样品的药理、毒理和理化性质,评估研发样品的危害。研发、注册及医学专业人员应该对样品临床前或临床药学、毒理学、药效学数据进行汇总、审核、分析、计算,对制定清洁方法、残留限度、残留限度检测方法,设计清洁工艺等方面进行全面研究。
3.1药品的毒理学评估和基于健康的暴露限度评价
提出了基于药理和毒理的计算方法和标准(基于健康的暴露限度(HBEL))l
3.2清洁工艺的设计和开发
按照全生命周期的清洁验证理念,应在研发阶段进行清洁工艺和残留物检测方法的开发。
本章节中再次强调了清洁验证的三个阶段,即:
第一阶段:清洁工艺设计和开发
根据产品开发过程中所获得的药理、毒理、溶解性等信息,进行清洁工艺设计及转移、放大,继而确定清洁工艺。
第二阶段:清洁工艺验证
确保开发和设计的清洁工艺可重复产生预期的结果。
第三阶段:持续清洁工艺确认
确保持续监控清洁过程关键参数和清洁效果,定期确认手工清洁的清洁效果,确保清洁工艺处于受控状态。
第四章主要介绍技术转移阶段对共线生产策略的考量。技术转移是药品生命周期中的一个关键阶段,是药品从研发到商业化生产的桥梁。
技术转移阶段的评估和转移工作的质量将对后续的商业化生产产生重大影响。对于拟共线生产的产品进行风险评估时应根据共线产品的具体问题进行分析,可参照但不限于以下方面进行风险识别和分析:
(1)拟共线生产品种的特性,如:
•产品类别(如化学药品、中药制剂、生物制品、药用辅料等)
•毒性(如是否具有细胞毒性、治疗窗窄、基因毒性、致癌性等,PDE值、职业接触限值(OEL)、毒性饮片等)
•活性
•致敏性
•溶解度
•活性微生物
•性状(如:颜色、气味、粘度等)
•物质状态(如:固态、液态等)
(2)共线生产品种的工艺
•最终灭菌或无菌生产工艺
•采用生物工艺进行生产(生物安全性风险)
•生产过程中所用物料的特性(如溶媒特性、生物安全性)
•其他
(3)共线生产品种的预定用途
•给药途径(如口服、外用、肌肉注射、静脉注射、鞘膜内注射等)
•临床适应症
•用药禁忌、配伍禁忌或联合用药
•用药对象(如老年人、孕妇、儿童)
•用药剂量
•长期用药(药品在体内是否蓄积并产生毒性)
(4)拟共线品种的厂房、设施共用情况
•厂房、空调系统
•设备种类、材质
•清洁难易程度、清洁方法与清洁验证
•设备控制方式及生产能力
•暴露情况,包括识别暴露的潜在途径和来源等
本章节特别列出了特殊品种共线应考虑的因素:
临床试验用药品与商业化药品共线
中药产品共线
生物制品共线
最终灭菌产品和非最终灭菌产品共线
某些激素类、细胞毒性类、高活性化学药品共线
基因治疗和细胞治疗产品共线
麻醉药品、精神药品和药品类易制毒化学品共线
青霉素类及β-内酰胺结构类等产品共线
第五章,药品生产阶段对共线生产策略的考量,药品生产阶段应针对共线生产产品间的污染和交叉污染途径制定可行的控制措施,不定期对控制措施的执行情况进行检查,以确保持续有效地执行控制措施。在药品生产中产生污染和交叉污染的途径主要包括以下几个方面:
①残留(Retention)
指更换产品时直接接触产品的部分设备内表面未能清洁至残留限度以下,通过共用设备将一种产品残留带入到接续生产的产品中引起的污染和交叉污染
如产品A和产品B生产时共用某混合机,产品A生产结束后混合机内表面产品A的清洁未达到要求的清洁限度,接下来生产产品B使用该混合机时导致混合机内表面残留的产品A混入产品B造成交叉污染
②机械转移(MechanicalTransfer)
指更换产品时非直接接触产品的设施、设备外表面未能清洁至目视合格,将产品通过操作人员衣服/手套等与设备外表面接触带入到另一产品中引起的污染和交叉污染;
如产品A和产品B生产时共用某混合机,产品A生产结束后混合机外表面产品A的清洁不完全,接下来生产产品B时操作人员手套接触残留在混合机外表面的产品A,导致产品A混入产品B造成交叉污染。
③空气传播(AirborneTransfer)
指产品或物料以粒子或气溶胶的形式通过气流组织沉降到另一个产品中。
④混淆(Mix-up)
指生产过程中因物料、产品、标签等的混淆(多为系统设计缺陷和人为失误),而导致污染和交叉污染。
第六、七章分别是术语、参考法规与指南,这里不做过多介绍。
小结
药品作为一种特殊的产品,关系重大,其生产过程中的质量要求始终是重中之重,无论是小试/确认批的产品,还是工艺验证的产品,只要二者存在设备共线或切换生产的情况,均需要根据产品相关的毒理数据、批量、日剂量等信息,制定相应的清洁残留限度并执行清洁活动,避免生产产品之间的交叉污染,保证药品安全、有效和质量可控,从而保证患者的用药安全。
参考资料:
1.药品共线生产质量管理指南(征求意见稿)
扫描下方二维码,关注博药微信公众号,回复关键词“课件”, 根据提示填写信息;您的资料通过审核后,课件将直接推送至微信中。请勿取关,以免无法及时收到系统推送。

友情提示:1.为确保您能及时收到讲座课件,建议提供工作邮箱。感谢配合!
2. 讲座ppt申领截至日期:7月27日(星期三)申领通过后将会于1-2个工作日通过公众号推送哦